
В Испании эксперименты на мышах доказали эффективность нанороботов, а в США ученые тестируют перспективные препараты иммунотерапии и комбинации противоопухолевых лекарств. Что произошло за последнее время на фронте борьбы с уротелиальной карциномой? Свежий дайджест наиболее заметных достижений – в этой статье.
Нанороботы атакуют опухоль с помощью изотопов йода
Исследователи из Каталонского института биоинженерии в Барселоне научились использовать микроскопические нанороботы для воздействия на раковую опухоль мочевого пузыря изнутри. Целую «армию» таких крошечных бойцов доставляют внутрь органа с помощью катетера, а их направленное движение обеспечивается с помощью уреазы – фермента, катализирующего распад мочевины на углекислый газ и аммиак.
В ходе реакции распада высвобождаются ионы, поток которых создает импульс. Он минимален и ненаправлен. Но если множество ферментов прикрепить к поверхности микроскопически малых силиконовых сфер, они придут в движение. В результате получается наноробот (или коротко – нанобот) «с энзимным приводом».
В мочевом пузыре, где топливо - мочевина - имеется в изобилии, такие нанороботы способны преодолевать определенные расстояния. От удара о гладкую стенку мочевого пузыря они отталкиваются, но в изборожденной поверхности опухоли - застревают.
Подобные локальные инстилляции уже стали стандартом в лечении уротелиальной карциномы. Например, таким образом вводится антибиотик митомицин С, обладающий цитостатическим действием, или вакцина против туберкулеза БЦЖ, которая активирует местную защиту от рака.
Однако оба метода оказывают лишь ограниченный эффект. В частности, большая часть митомицина С и БЦЖ выводится из организма со следующим мочеиспусканием. Кроме того, неприцельное воздействие митомицина повреждает здоровую слизистую оболочку, что приводит к многочисленным побочным эффектам.
Метод, представленный учеными из Барселоны, представляет собой введение в мочевой пузырь нанороботов, состоящих из пористых силиконовых сфер диаметром 450 нанометров и снабженных многочисленными молекулами уреазы. Молекулы обеспечивают необходимую движущую силу и защищены от разложения с помощью специальной технологии модификации.
Вооружение наноботов – это радиоактивный изотоп йода I-124 - радионуклид, часто используемый в медицине. Его период полураспада составляет 8,02 дня, что обеспечивает достаточно длительный период воздействия. При этом I-124 - бета-излучатель имеет короткий радиус действия (около 0,8 мм), поэтому здоровые ткани вблизи опухоли не будут затронуты. Наноботы также оснащаются трейсером для позитронно-эмиссионной томографии, чтобы его накопление в опухоли можно было наблюдать извне.
Исследователи протестировали лечение на мышах, зараженных клетками уротелиальной карциномы. ПЭТ показала, что после инстилляции наноботов в опухоль их количество увеличилось в восемь раз. Они проникли в ее глубокие слои, что исследователи смогли продемонстрировать с помощью специально разработанного флуоресцентного микроскопа.
Теперь нужны клинические испытания, чтобы выяснить, достаточно ли этого для того, чтобы сдерживать прогрессирование рака в течение длительного времени.
В принципе, нанороботы можно также нагружать цитостатическими препаратами. Вероятно, таким образом можно было бы использовать сильные цитотоксины, слишком токсичные для системной терапии. Переносимость такого лечения также предстоит выяснить в ходе клинических испытаний.
Иммунотерапия может сохранить мочевой пузырь даже при мышечной инвазии
Пациентам с карциномой, которая проросла в мышечный слой, но еще успела дать метастазы в лимфатические узлы или другие органы, в настоящее время рекомендуется полное удаление пузыря (радикальная цистэктомия). Многим эта процедура позволяет излечить рак.
Поэтому ведется поиск альтернативных вариантов, при которых мочевой пузырь можно сохранить. Проведенные ранее исследования показали, что неоадъювантная химиотерапия часто приводит к полной патологической ремиссии: в удаленном мочевом пузыре больше не обнаруживаются раковые клетки. То есть на самом деле радикальную операцию можно было бы и не проводить.
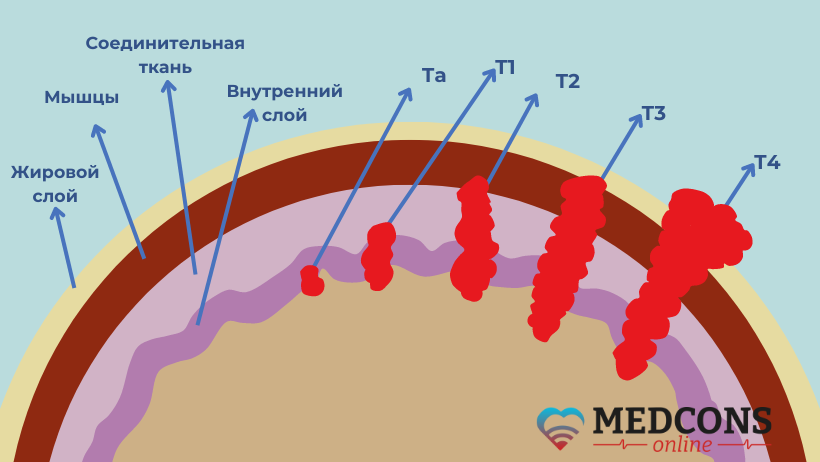
В настоящее время врачи из Института рака медицинского комплекса Маунт-Синай в Нью-Йорке выясняют, можно ли в некоторых случаях действительно отказаться от цистэктомии. В начатом медиками исследовании 2-й фазы приняли участие 76 пациентов с мышечно-инвазивным раком мочевого пузыря в стадии cT2-T4N0M0 (по TNM-классификации), то есть без регионарных и отдаленных метастазов (см. рис.1). У всех опухоль в пределах видимости была удалена в ходе трансуретральной резекции.
Сначала они получили четыре цикла химиотерапии (гемцитабин плюс цисплатин) одновременно с иммунотерапией ингибитором контрольных точек ниволумабом. После этого было проведено рестадирование с биопсией, цитологией мочи и магнитно-резонансной томографией.
У 33 пациентов (43%) ни одно из исследований не выявило признаков роста рака. Им было предложено отказаться от цистэктомии, заменив ее еще восемью циклами ниволумаба.
32 пациента приняли это предложение. Через 18-42 месяца у восьми из них возник рецидив, и им была проведена цистэктомия. Выяснилось, что в семи из этих восьми случаев опухоль не вышла за пределы мочевого пузыря.
Еще у одного пациента произошел отдаленный рецидив, а в целом только у двух из участников исследования развились отдаленные метастазы. По прошествии 30 месяцев остальные пациенты могут надеяться на излечение от рака без удаления мочевого пузыря, так как по опыту рецидивы обычно возникают в первые два года после химиотерапии.
Комбинированная терапия метастатической уротелиальной карциномы дает многообещающие результаты
До настоящего времени проблему представляет подбор препаратов первой линии у пациентов с метастатической уротелиальной карциномой, для которых терапия цисплатином является невозможной. На сегодняшний день для PD-L1-позитивных опухолей предлагаются альтернативные химиотерапевтические препараты или ингибиторы контрольных точек (антитела к PD-(L)1). Однако последние не демонстрируют достаточной эффективности при наличии изменений в рецепторе фактора роста фибробластов (FGFR).
Группа исследователей из Техасского университета в Хьюстоне в рандомизированном исследовании оценила эффективность и переносимость эрдатифиниба, ингибитора FGFR, в качестве терапии первой линии при метастазирующем раке мочевого пузыря с изменениями FGFR.
В исследование были включены 87 взрослых пациентов, еще не получавших системную терапию, которым лечение цисплатином было противопоказано. Они были рандомизированы в соотношении 1:1 в группу, получавшую монотерапию эрдафитинибом, или в группу, получавшую комбинированную терапию эрдафитинибом и антителом PD-1 цетрелимабом.
Медиана времени наблюдения составила 14,2 месяца. Ответ на терапию был выявлен у 24 участников в группе комбинированной терапии и у 19 - в группе монотерапии. В 6 случаях произошла полная ремиссия при использовании комбинации и в 1 – одного препарата.
В обеих группах 4 пациента были PD-L1-положительными. Из них 3 (75 %) ответили на лечение эрдафитинибом плюс цетрелимабом и ни один не ответил на лечение эрдафитинибом. Через год 68% пациентов были живы на эрдафитинибе плюс цетрелимаб и 56% на эрдафитинибе.
Отмечается также хорошая переносимость медикаментов: совместный прием не привел к каким-либо дополнительным токсическим эффектам/
Использованная литература
- Galsky, M.D., Daneshmand, S., Izadmehr, S. et al. Gemcitabine and cisplatin plus nivolumab as organ-sparing treatment for muscle-invasive bladder cancer: a phase 2 trial. Nat Med 29, 2825–2834 (2023).
- Simó, C., Serra-Casablancas, M., Hortelao, A.C. et al. Urease-powered nanobots for radionuclide bladder cancer therapy. Nat. Nanotechnol. (2024).
- Arlene O. Siefker-Radtke, Thomas Powles, Victor Moreno, Taek Won Kang, Irfan Cicin, Angela Girvin, Sydney Akapame, Spyros Triantos, Anne O'Hagan, Wei Zhu, Meggan Tammaro, and Yohann LoriotAUTHORS INFO & AFFILIATIONS. Erdafitinib (ERDA) vs ERDA plus cetrelimab (ERDA+CET) for patients (pts) with metastatic urothelial carcinoma (mUC) and fibroblast growth factor receptor alterations (FGFRa): Final results from the phase 2 Norse study. Journal of Clinical Oncology Volume 41, Number 16_suppl

Комментарии — 0